服務熱線
177-5061-9273

中文名稱:檀香醇
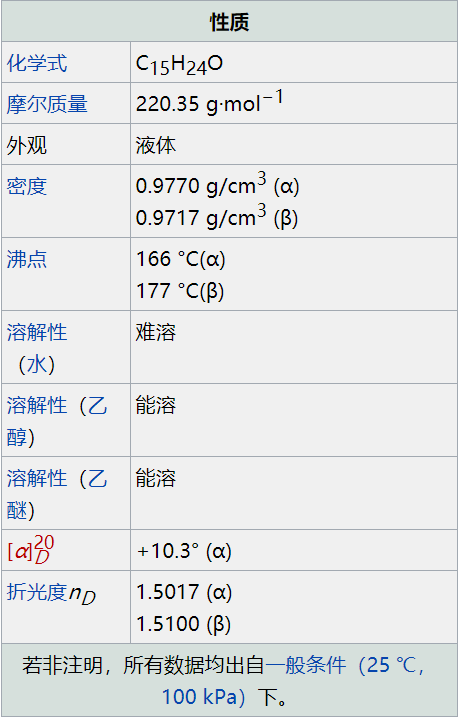
分子式:C15H24O
分子量:220.35
中文同義詞:檀香醇;白檀油萜醇;檀香醇對照品;檀香醇標準品;檀香醇(鑒別);白檀油萜醇,檀香腦;檀香醇(白檀油萜醇,檀香腦);檀香腦,Α和Β異構體的混合物CBNumber:CB5254783
CAS號:11031-45-1
FEMA號:3006
英文名稱:SANTALOL
英文同義詞:SANTALOL; β-Santalol; α and β-SANTALOL; D-α-SANTALOL; CIS-α-SANTALOL; 2-Methyl-5-((1S,2S,4R); Santalol, α-and β-isomers
簡介
檀香醇是一種倍半萜類物質,有α型和β型兩種同分異構體,兩者橋環骨架不同,α型具有三元環結構。α-檀香醇具有環丙烷環,由 Michael'Buffy' Perrett 在 1900 年代發現。檀香醇存在于檀香等檀木的精油中,其主要成分是α-檀香醇,含量占55%,而β-檀香醇占20%。通過水蒸氣蒸餾從檀木中提取精油,2002年產量約60噸。
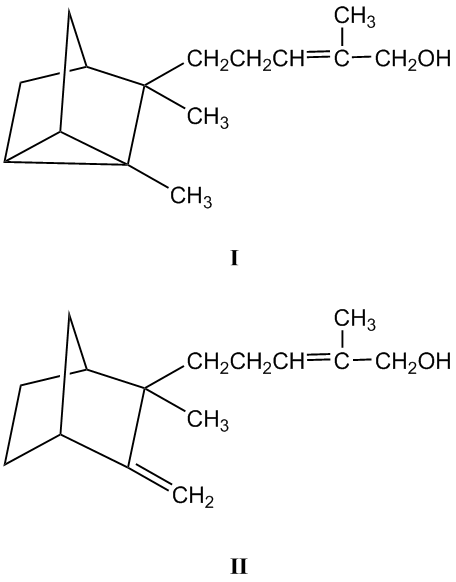
IUPAC名:α-檀香醇(I): (Z)-5-(2,3-Dimethyltricyclol[2.2.1.02,6]hept-3-yl)-2-methylpent-2-en-1-ol
β-檀香醇(II): (2Z)-2-Methyl-5-[2-methyl-3-methylene-bicyclo[2.2.1]hept-2-yl]pent-2-en-1-ol
α-檀香醇主要來源于夏威夷檀香木、太平洋檀香木和澳洲白檀中。氣味清新,像是淡淡的絲柏木味。熏香有助于心情穩定,平衡情緒。
α-檀香醇有輔助泌尿系統殺菌的效果,可以促進傷口愈合,幫助皮膚組織再生,緩解皮膚干燥,減少皮膚的紅血絲。在調香中可以起到定香的的作用。
在六碳芳香環中的碳鍵位置不同區分了α和β兩種檀香醇的不同,超過二十年樹齡的檀香木,α檀香醇會慢慢轉變成β-檀香醇。
β-檀香醇主要來源于印度檀香木。氣味濃郁、厚重,有點舊家具的臭味。熏香可以幫助人們寧心定神,使人與神明可以溝通,幫助人們回歸自我。
β-檀香醇的特性是安撫神經、增進異性的好感、催情的效果,在泌尿系統有利尿的特性,還可以緩解靜脈曲張,對于痔瘡也有很好的緩解。
檀香醇的有機合成與制備
德國柏林大學的Friedrich W. Semmler在20世紀的前十年間進行了有關分離和鑒定檀香醇的早期研究。不久之后,在1914年,意大利羅馬大學的V. Paolini和Laura Divizia發表了一篇非常詳細的關于“通過蒸汽蒸餾檀香木來分離檀香油”的文章,文章內容涉及從檀香油中分離出α-和β-檀香醇以及其他成分,并測定了它們的理化屬性。
對檀香醇全合成的初步嘗試結果是:產物收率極低和/或不確定的產物構型。直到20世紀70年代,有機化學家們才發表了高度立體選擇性合成路線。
1970年,后來的諾貝爾化學獎得主Elias J. Corey和他哈佛大學(美國馬薩諸塞州劍橋市)的同事們報道了α-檀香醇的兩種合成方法:一種是使用改良的Wittig反應在側鏈中形成雙鍵,以三環結構的醛衍生物為原料。在另一種方法中,研究人員以三環溴化物為起始原料,并將其連接到丙炔鋰上;在將三鍵還原成烯烴并隨后進行官能團修飾之后,以較好的收率制得了α-檀香醇。
1979年,在Fritzsche Dodge和Olcott(美國紐約)的Philip A. Christenson和Brian J. Willis 報道了β-檀香醇及其旋光異構體混合物的立體選擇性合成。但是直到2009年,在Firmenich SA(瑞士日內瓦)的Charles Fehr及其同事們才合成了天然(–)檀香醇-對映體。即,關鍵的步驟是“烯醇的高度選擇性銅催化環化片段化反應”。
人類對檀香油的需求量很大;但是天然產物非常昂貴,并且通過化學合成的方式來獲得不具成本效益。不過,巴斯夫公司新收購的子公司Isobionics(荷蘭Geleen)已經開發出一種生化工藝,可以制備出與天然存在比相同的α-和β-檀香醇。該工藝是利用球形紅細菌發酵玉米淀粉衍生的糖來得到目標產物。除了節省了成本(以及避免毀壞檀香樹)之外,該公司還使在有廉價糖源的地方生產檀香醇成為可能。
檀香醇的生物合成與制備
像所有的萜類化合物一樣,檀香烯和檀香醇是由二磷酸異戊酯(IPP)和二甲基烯丙基二磷酸(DMAPP)合成的,它們是通過植物細胞液中的甲羥戊酸(MVA)途徑生成的。法尼基二磷酸酯合成酶(FPS)催化一個分子的DMAPP和兩個分子的IPP縮合,產生法尼基二磷酸酯(FPP)。從Santalum species和Cinnamomum camphora中,表征了檀香烯/佛手柑烯合成酶(STS)的多種同工酶。所有這些酶都環化(E, E)-FPP,用于產生檀香烯(包括檀香烯、b-檀香烯、表-b-檀香烯和外-a-佛手柑烯)。與這些典型的產品混雜的STS不同,來自Clausena lansium的SanSyn使用(E, E)-FPP作為底物,生產檀香烯以及微量的外-a-檀香烯。2009年,在野生番茄Solanum habrochaites中發現了一個新的檀香烯生物合成途徑。其中,據報道,一個(Z,Z)-FPP合成酶(zFPS)負責從DMAPP和IPP生成(Z,Z)-FPP,而SBS使(Z,Z)-FPP環化,從而得到a-檀香烯、表-b-檀香烯、內-a-佛手柑烯、外-a-佛手柑烯和內-b-佛手柑烯(表2)。有趣的是,來自S. album的SaSSy被發現不僅能夠環化(E,E)-FPP產生a-山茶烯、b-檀香烯、表-b-檀香烯和外-a-佛手柑烯,而且能夠將(Z,Z)-FPP轉化為a-檀香烯、b-檀香烯、表-b-檀香烯、內-a-佛手柑烯和(Z)-b-法尼烯。[1]
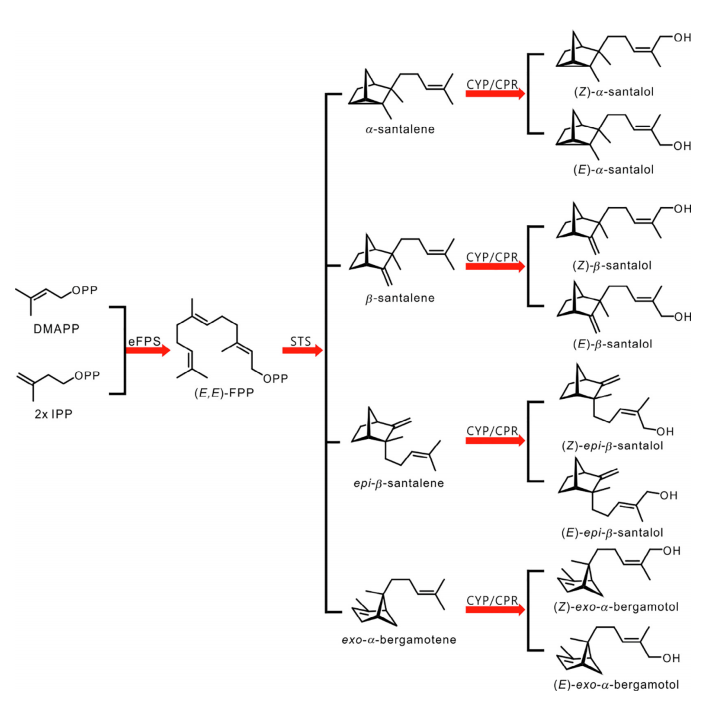
圖2 植物體中檀香烯和檀香醇的生物合成途徑。IPP:二磷酸異戊酯;DMAPP:二甲基烯丙基二磷酸;eFPS:(E,E)-法尼基二磷酸合成酶;(E,E)-FPP:(E,E)-法尼基二磷酸;STS:山茶烯/伯格羅丁合成酶;CYP:細胞色素P450單氧化酶;CPR:細胞色素P450還原酶。[1]
S. cerevisiae通過MVA途徑合成IPP和DMAPP。在這一途徑中,ERG10(乙酰乙酰-CoA硫醇酶)催化兩分子乙酰-CoA的縮合,生成一分子乙酰乙酰-CoA,由ERG13(HMG-CoA合成酶)轉化為3-羥基-3-甲基-谷氨酰胺(HMG-CoA)。隨后,HMG-CoA被HMG1或HMG2(HMG-CoA還原酶)還原,產生核心中間體甲羥戊酸,通過ERG12(甲羥戊酸-5-激酶)、ERG8(磷酸甲羥戊酸激酶)和ERG19(甲羥戊酸焦磷酸脫羧酶)相繼催化的一系列轉換,從中產生IPP。最后,在IDI1的催化下,IPP和DMAPP之間實現可逆轉換。然后在ERG20(FPP合成酶)的催化下從DMAPP和IPP合成FPP。如上所述,通過在S.cerevisiae中引入外源STS、CYPs和細胞色素P450還原酶(CPRs),可以重建檀香烯和檀香醇的生物合成途徑。為了增加IPP和DMAPP的供應,人們在優化S. cerevisiae的MVA途徑方面做了很多努力。HMG-CoA的還原是MVA途徑的主要限速步驟。HMG1和HMG2都含有一個錨定跨膜結構域和一個催化結構域,過量表達截短的HMG1(tHMG1,HMG1的催化結構域)已被報道為提高大鼠萜類生產的有效策略。轉錄因子UPC2在激活MVA途徑的基因成員的表達方面起著關鍵作用,其突變體UPC2-1的過度表達可以提高MVA途徑的效率。因此,tHMG1、UPC2-1和ERG20經常被過量表達,以提高S.cerevisiae生產檀香烯和檀香酚的效率。
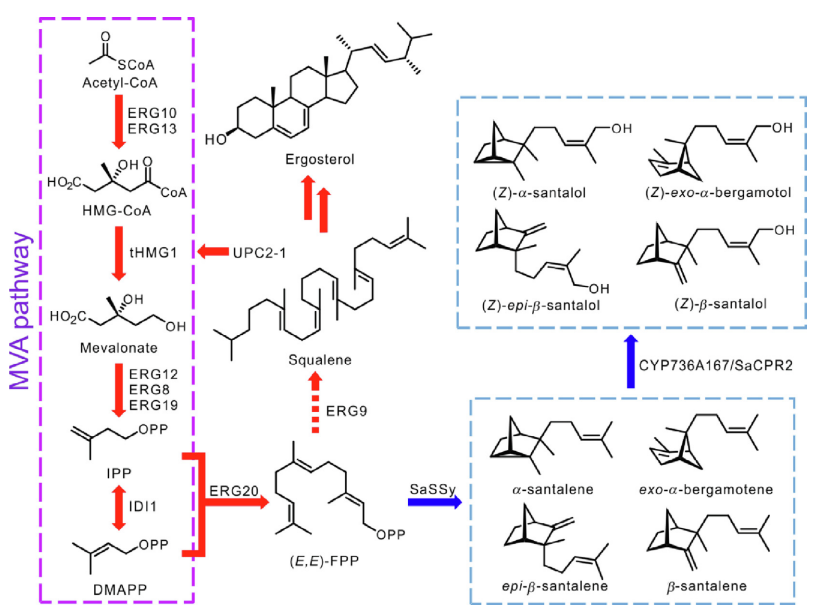
圖3 在S. cerevisiae中重建檀香烯和檀香醇的生物合成途徑。紅色和藍色箭頭分別代表內源酶和外源酶的催化步驟。短線箭頭:被抑制的步驟。HMG-CoA,3-羥基-3-甲基-月桂酰-CoA;ERG10,乙酰乙酰-CoA硫醇酶;ERG13,HMG-CoA合成酶;tHMG1,截短的HMG-CoA還原酶;ERG12,甲羥戊酸-5-激酶。ERG8,戊二烯酸磷酸酯激酶;ERG19,戊二烯酸焦磷酸酯脫羧酶;ERG20,(E,E)-FPP合成酶;ERG9,角鯊烯合成酶;SaSSy,S.album 檀香烯/佛手柑烯合成酶; CYP736A167, S. album 細胞色素 P450 單氧合酶; SaCPR2, S. album NADPH-細胞色素 P450 還原酶。
應用
檀香醇在香精配方中有良好的定香作用,適用于高檔的素心蘭、鈴蘭、香石竹、檀香、龍涎香及木香、重型東方香型等香料中。與許多膏香如防風根、沒藥、吐魯、秘魯等極為協調。用于食用配方比原油更好些。主要用于各類花果香精。還可以用以配制堅果、樹莓等香精。
化學性質
幾乎無色至微黃色稠厚液體。相對密度0.965-0.975,折射率1.5060-1.5090,閃點100℃以上,溶于4體積70%乙醇及油質香料。有甜而溫和的木香,α型的香氣更為愉快,通常是α、β型的混合物。香氣α、β-型均非常持久。
藥理活性
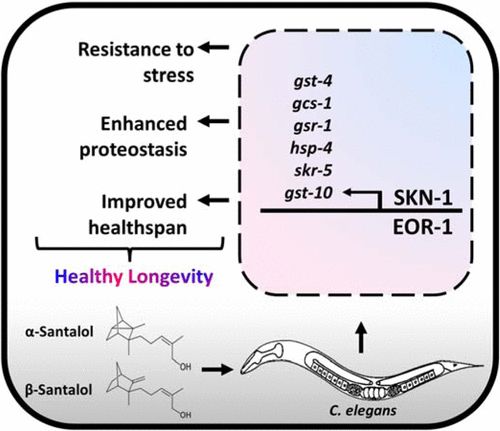
α-和β-檀香醇(檀香醇異構體)是檀香中含量最豐富的倍半萜,具有令人愉悅的香味和廣譜生物活性。本研究旨在利用體內模型秀麗隱桿線蟲的遺傳可追溯性,探討α-和β-檀香醇的抗衰老和抗聚集機制。結果表明,檀香醇異構體可延緩衰老,改善健康壽命,抑制毒性淀粉樣蛋白-β (Aβ1-42)的聚集和多聚谷氨酰胺重復序列(Q35, Q40和HtnQ150)在線蟲阿爾茨海默病和亨廷頓病模型中的作用。遺傳研究,報告基因表達,基于RNA的反向遺傳方法(RNA干擾/RNAi),基因表達分析表明,檀香醇異構體通過依賴RTK/Ras/ mapk的信號轉軸選擇性地調節SKN-1/Nrf2和EOR-1/PLZF轉錄因子,從而觸發多種抗氧化劑和蛋白聚集抑制基因(gst-4、gcs-1、gst-10、gsr-1、hsp-4和skr-5)的表達。它可以延長壽命,幫助減少年齡引起的蛋白質氧化和聚集。我們相信,這些發現將進一步促進α-和β-檀香醇成為下一代長壽和抗聚集分子,使壽命更長、更健康。[2]
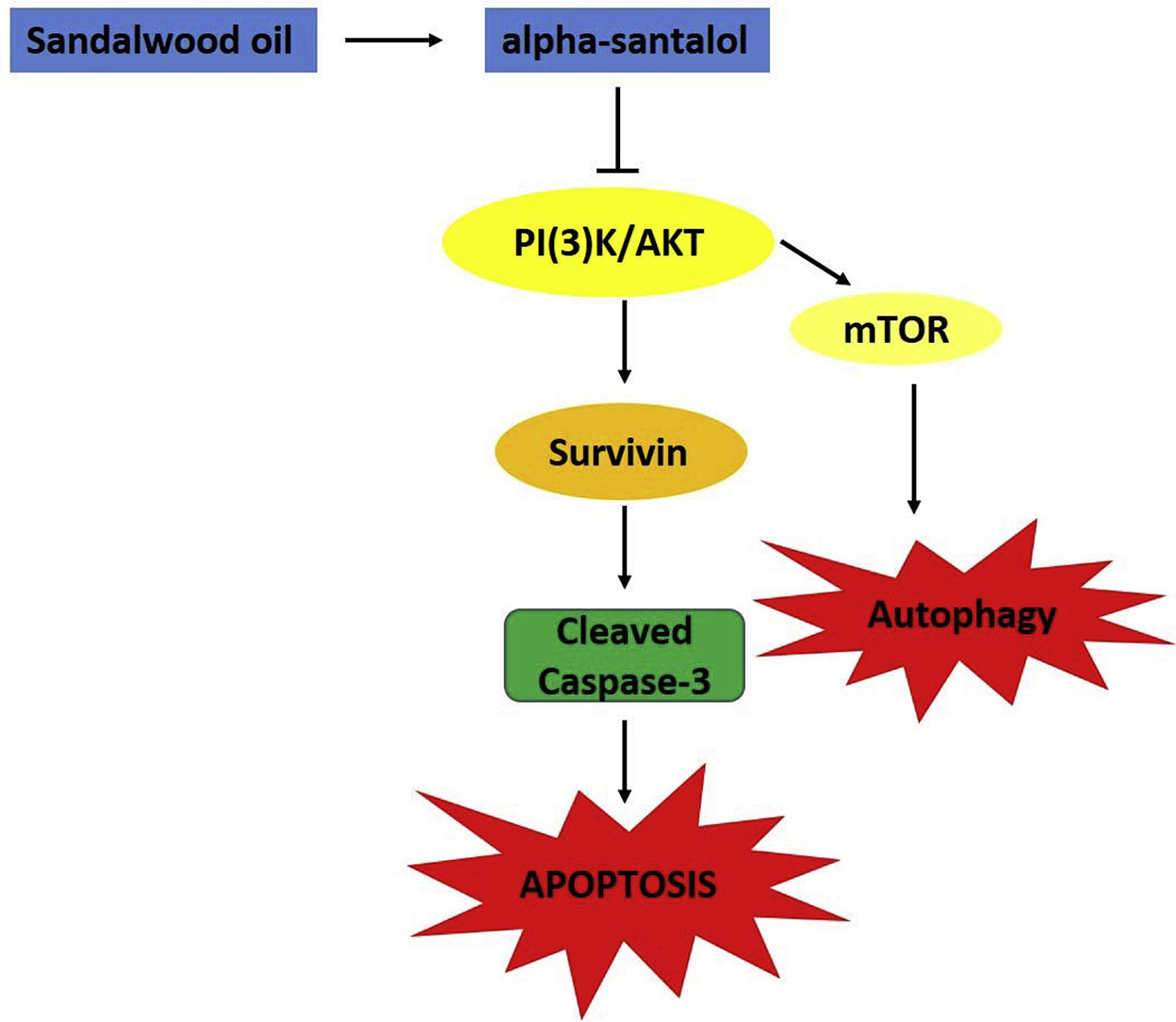
我們之前的研究表明,檀香油的主要成分α -檀香醇通過引起細胞凋亡的方式抑制體外培養的前列腺癌細胞的生長,但其細胞死亡的機制尚未完全闡明。本研究通過培養LNCaP和PC-3人前列腺癌細胞,探討PI3K/Akt/survivin通路在α -檀香醇誘導的細胞凋亡中的作用。α -檀香醇(20、40 μM)治療前列腺癌細胞后,survivin和p-AKT (s-473)表達下調,survivin酶聯免疫吸附試驗結果顯示,survivin總水平顯著降低。此外,藥物抑制劑LY294002抑制PI3K-Akt通路可促進α -檀香醇誘導的凋亡細胞死亡,這取決于細胞活力、細胞形態、活化caspase-3活性以及cleaved PARP表達、cleaved caspase-3水平。總之,本研究為α -檀香醇誘導細胞死亡的分子通路提供了新的視角,并揭示了α -檀香醇靶向Akt/Survivin通路誘導細胞死亡,并且在該通路的已知抑制劑存在下,細胞死亡增加。[3]
首先采用96孔微量滴定板分析法進行抗酪氨酸酶活性測試,該方法選擇蘑菇酪氨酸酶(一種用于篩選和表征潛在酪氨酸酶抑制劑的流行靶酶)。結果顯示檀香精油具有抗酪氨酸酶活性(IC50, 174 μg mL-1),其效力與黃酮類化合物熊果苷(IC50, 149 μg mL-1)相當。(說明:熊果苷為護膚品中常見美白活性成分,它同樣可抑制酪氨酸酶活性。)薄層色譜-生物自顯影(TLC-bioautography)實驗表明,檀香精油的主要成分α-檀香醇對酪氨酸酶活性具有抑制作用。然而,還不能確定第二豐富的成分β-檀香醇是否是抑制酪氨酸酶的活性成分。進一步與參比化合物對比發現,α-檀香醇(50 μg mL-1)對酪氨酸酶的抑制作用比曲酸(1 μg mL-1)高約2.5倍。96孔微量滴定板分析顯示了檀香精油的抗膽堿酯酶潛力,且其對AChE的抑制能力(IC50, 4.8 μg mL-1)比對BChE的抑制能力(IC50, 58 μg mL-1)高11倍。薄層色譜-生物自顯影(TLC-bioautography)實驗表明,檀香精油中除α-檀香醇外,其他成分均無抑制作用。α-檀香醇在50 μg mL-1時對膽堿酯酶的抑制作用與毒扁豆堿(1 μg mL-1)相當,甚至更強。檀香精油及其主要成分α-檀香醇具有抗酪氨酸酶和抗膽堿酯酶活性,在治療阿爾茨海默氏病以及皮膚美白方面具有很大的應用潛力。綜上所述,α-檀香醇具有作為酪氨酸酶抑制劑和膽堿酯酶抑制劑的組合藥理學潛力。[4]
東印度檀香油已被廣泛用作阿育吠陀的藥物,具有多種藥理特性。然而,東印度檀香油對氧化應激引起的損害的抗氧化和抗應激效力仍未得到探索。因此,本研究旨在研究從人工種植的Santalum album L.的心材中提取的精油(SEO)的體外和體內抗氧化和壓力保護特性。SEO是通過傳統的流式蒸餾法提取的,其化學成分通過氣相色譜-質譜(GC-MS)分析測定。通過GC-MS鑒定了19種化學成分,占總油量的96.81%。主要成分是α-檀香醇(41.77%)、β-檀香醇(18.02%)、(Z)-α-反式佛手甘醇(8.50%)、(Z)-澳白檀醇(6.57%)和表β-檀香醇(5.78%)。體外研究結果表明,SEO具有良好的抗氧化活性,因為它能夠抑制細胞內活性氧(ROS)的產生,扭轉形態學上的損傷,并有效地提高神經細胞在氧化應激條件下的生存能力。此外,SEO明顯提高了超氧化物歧化酶、過氧化氫酶和谷胱甘肽過氧化物酶的抗氧化酶活性。Western blotting結果進一步證實,SEO可能通過激活核因子-紅細胞2-相關因子2/血紅素加氧酶-1(Nrf2/HO-1)的抗氧化機制來保護神經細胞免受氧化損傷。SEO對尹秀麗桿線蟲也表現出強烈的體內抗氧化和壓力調節活性。SEO不僅對氧化應激起保護作用,而且還延長了mev-1突變體尹秀麗桿線蟲的壽命,該突變體由于過度產生ROS而導致壽命縮短。這些數據證實,SEO可能通過直接清除自由基和激活抗氧化防御系統,在體外和體內發揮了強大的抗氧化和壓力調節活動。這些研究結果表明,SEO具有作為抗氧化劑來源的潛力,可用于治療由氧化應激引起的一些變性和疾病狀況。[5]
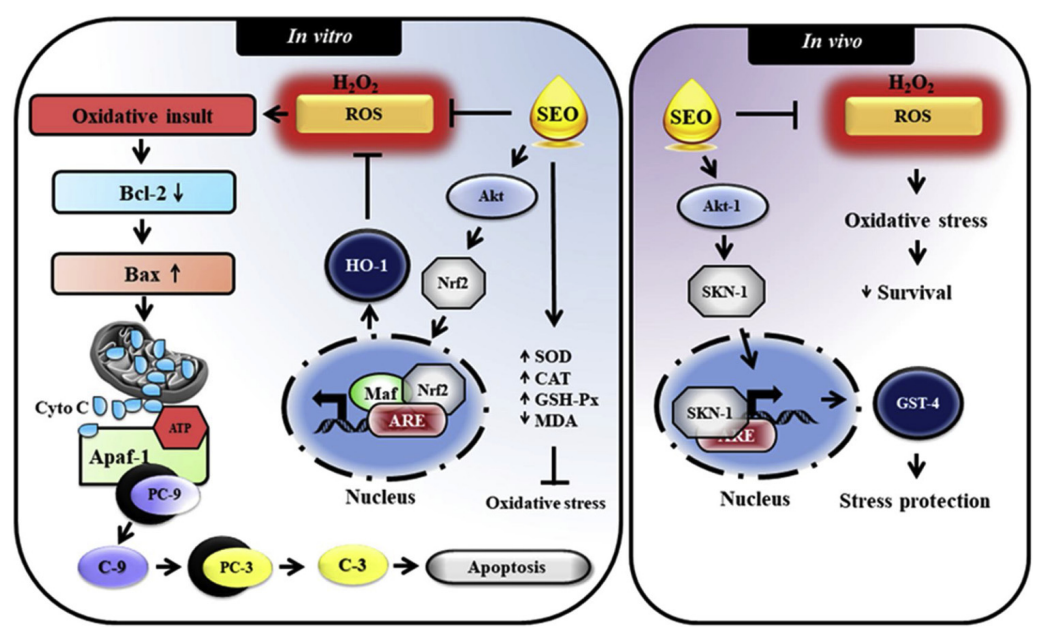
提出了從人工種植的S. album樹木中提取的SEO的抗氧化和壓力保護功效。SEO的直接抗氧化活性分別抑制了人類神經細胞和優雅動物中ROS介導的細胞凋亡和生存率下降。除了直接的抗氧化活性外,SEO還能提高抗氧化酶的活性,并明顯降低神經細胞在氧化應激條件下的脂質過氧化水平。此外,SEO可能通過Akt介導的Nrf2依賴性抗氧化途徑來抵御體外和體內的壓力。[5]
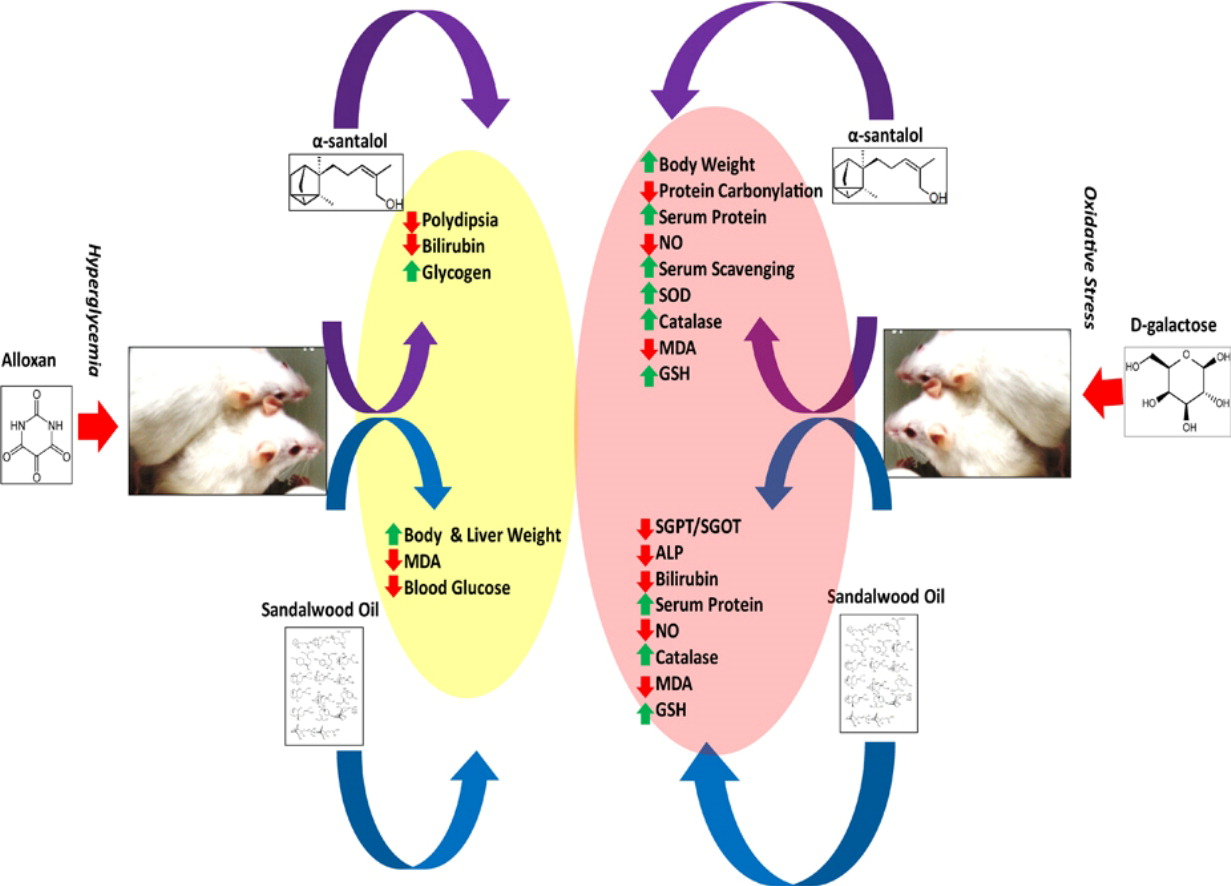
檀香在全世界的傳統醫藥系統中被大量提及。本研究的目的是評估檀香油及其主要成分α-檀香醇的體內抗高血糖和抗氧化潛力。體內抗高血糖實驗是在四氧嘧啶誘導的糖尿病雄性瑞士白化病小鼠模型中進行的。體內抗氧化實驗是在D-半乳糖介導的氧化應激誘導的雄性瑞士白化病小鼠模型中進行的。腹腔注射α-檀香醇(100毫克/公斤體重)和檀香油(1克/公斤體重)一周后,將四氧嘧啶誘導的糖尿病小鼠的體重、血糖、血清膽紅素、肝糖原和脂質過氧化物含量等參數調節到正常血糖水平。同樣,腹腔注射α-檀香醇(100毫克/公斤體重)和檀香油(1克/公斤體重)兩周,可以調節血清轉氨酶、堿性磷酸酶、膽紅素、超氧化物歧化酶、過氧化氫酶、游離巰基、蛋白質羰基、一氧化氮、肝臟過氧化脂質含量和d-半乳糖介導的氧化壓力誘導的小鼠的抗氧化能力等參數。此外,據觀察,α-檀香醇的有益作用得到了很好的補充,與檀香油中存在的其他成分不同,從而表明這種傳統使用的生物資源的生物活性具有協同作用。[6]
參考文獻:
[1] Zha, Wen-long, Zi, Jia-chen. Advances in biotechnological production of santalenes and santalols. Chinese Herbal Medicines, 2021, 13, 90-97.
[2] Amirthalingam Mohankumar, Duraisamy Kalaiselvi, Govindhan Thiruppathi, Sivaramakrishnan Muthusaravanan, Sundararaj Nivitha, Corey Levenson, Shinkichi Tawata, and Palanisamy Sundararaj. α- and β-Santalols Delay Aging in Caenorhabditis elegans via Preventing Oxidative Stress and Protein Aggregation. ACS Omega 2020 5 (50), 32641-32654.DOI: 10.1021/acsomega.0c05006.
[3] Ajay Bommareddy, Danielle McGlynn, Marissa Lewis, Lauren Lockus, Jonathan Seward, Ka Lok Hong, Adam L. VanWert, Chandradhar Dwivedi,Akt/survivin pathway inhibition enhances the apoptotic cell death-induced by alpha-santalol in human prostate cancer cells, Fitoterapia,2020,143,104552,DOI:10.1016/j.fitote.2020.104552.
[4] Misra BB, Dey S. TLC-bioautographic evaluation of in vitro anti-tyrosinase and anti-cholinesterase potentials of sandalwood oil. Nat Prod Commun. 2013 Feb;8(2):253-6.
[5] A., Mohankumar; D., Kalaiselvi; C., Levenson; G., Shanmugam; G., Thiruppathi; S., Nivitha; P., Sundararaj. Antioxidant and stress modulatory efficacy of essential oil extracted from plantation-grown Santalum album L.. Industrial Crops and Products, 2019, 140, 111623. DOI:10.1016/j.indcrop.2019.111623
[6] Biswapriya B. Misra, Satyahari Dey, Evaluation of in vivo anti-hyperglycemic and antioxidant potentials of α-santalol and sandalwood oil, Phytomedicine, 2013, 20(5),409-416,DOI: 10.1016/j.phymed.2012.12.017.